法國製藥巨頭賽諾菲(Sanofi)近日在舊金山舉行的美國糖尿病協會(ADA2019)第79屆科學會議上公布了降糖藥Soliqua/Suliqua(甘精胰島素100U/mL和利西那肽)治療2型糖尿病(T2D)患者的III期臨床研究LixiLan-G的完整數據。該研究在接受GLP-1受體激動劑(GLP-RA)治療但未能充分控製血糖水平的T2D成人患者中開展,結果顯示,治療26周後,與繼續接受GLP-1 RA治療的患者相比,接受Soliqua治療的患者血糖水平(HbA1c)顯著降低,達到了研究的主要終點。
值得一提的是,該研究是將Soliqua與每日一次和每周一次GLP-1 RA藥物進行對比的首個研究。研究中的對照藥物包括每日一次或每周一次GLP-1 RA藥物。與繼續接受先前GLP-1 RA治療的患者相比,轉向Soliqua治療的患者中有更高比例的患者達到HbA1c<7%(ADA推薦的治療目標)、同時也有更高比例的患者達到HbA1c<7%且沒有記錄的症狀性低血糖的複合終點。
具體數據如下所示:
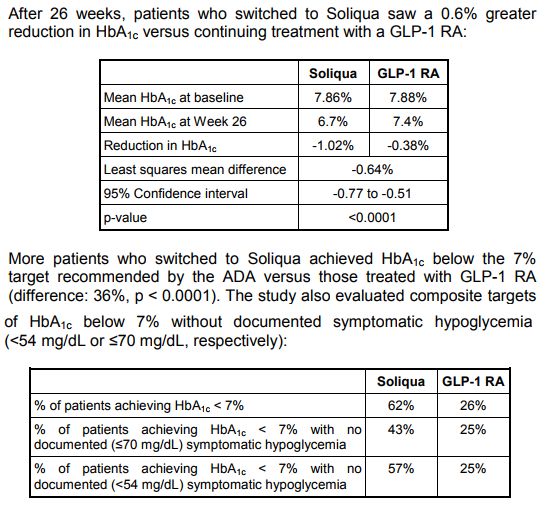
該研究中,安全性和所研究藥物的已知安全性一致。最常見的不良事件為胃腸道事件(即惡心、腹瀉或嘔吐)和低血糖。
賽諾菲全球糖尿病醫療事務主管Rachele Berria表示:“我們致力於為糖尿病患者提供廣泛的選擇,幫助他們進行個性化護理。作為Soliqua與每日一次及每周一次GLP-1 RA藥物的第一次比較,該研究為醫師提供了新的數據,當他們將Soliqua作為個性化治療計劃的一部分時,可以使用這些數據。”

Soliqua由固定劑量的基礎甘精胰島素(100U/mL)和一種胰高血糖素樣肽-1受體激動劑(GLP-1 RA)lixisenatide(利西拉肽,33mcg/mL)組成的糖尿病複方藥物,2者具有互補性的降血糖療效。其中,基礎甘精胰島素作用於空腹血糖,lixisenatide作用於餐後血糖,2者均有助於降低糖化血紅蛋白(HbA1c)水平。
Soliqua是一種注射藥物,每日注射一次,該藥適應症為:(1)作為飲食和運動的附加療法,用於接受長效胰島素或利西那肽治療血糖不受控的2型糖尿病成人患者;(2)用於接受口服降糖藥治療血糖不受控的2型糖尿病成人患者。