2月28日宣布,美國食品藥品監督管理局(FDA)已批準其藥物SKYCLARYS(omaveloxolone),用於治療成人和16歲及以上青少年弗裏德裏希共濟失調(Friedreich's Ataxia)。該公司表示,Skyclarys是第一種也是唯一一種適用於弗裏德裏希共濟失調患者的藥物。該藥物已獲得美國FDA的孤兒藥、快速通道和罕見兒科疾病稱號,以及歐洲委員會(EC)的孤兒藥稱號。此外,歐洲藥品管理局(EMA)目前正在審查該藥物的上市授權申請。
Reata旨在通過恢複線粒體功能來治療弗裏德裏希共濟失調。其藥物omaveloxolone是一種靶向並激活一種轉錄因子Nrf2的小分子,該公司表示它在緩解炎症中起關鍵作用。omaveloxolone旨在穩定Nrf2並增加其活性。
FDA對SKYCLARYS的批準基於關鍵、安慰劑對照、雙盲2期MOXIe研究(研究1;NCT02255435),以及非盲MOXIe延展研究的事後傾向匹配分析的療效和安全性數據。
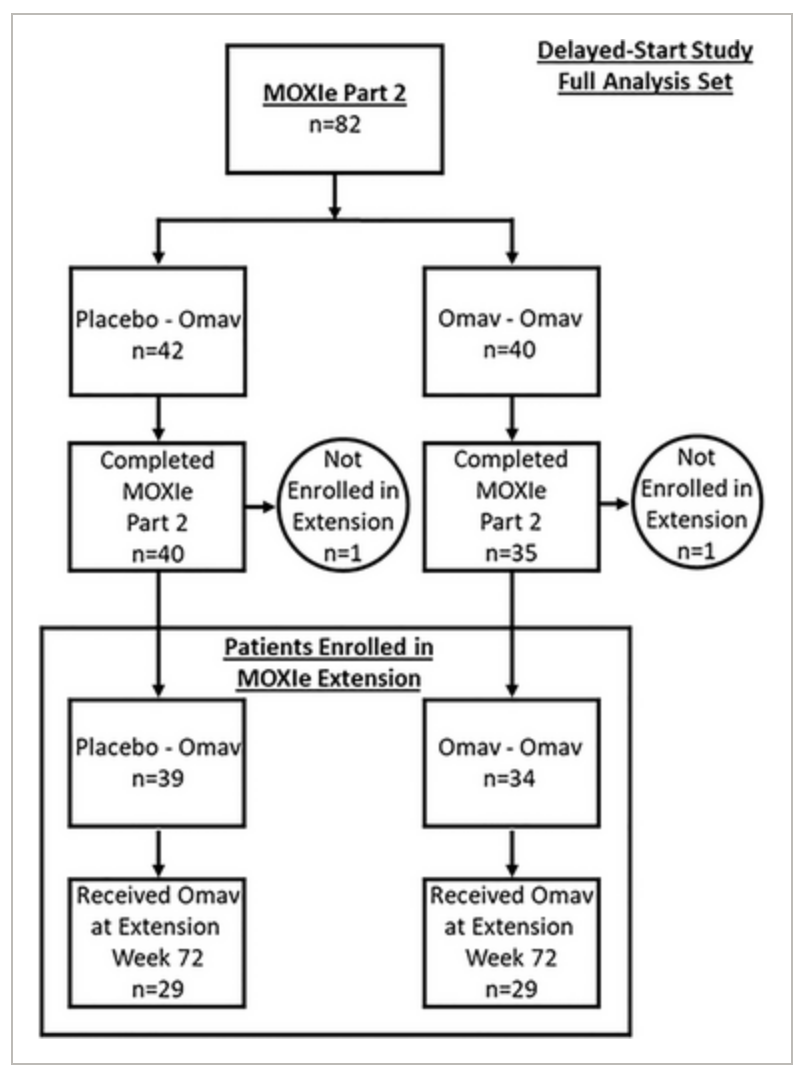
研究1招募了103名弗裏德裏希共濟失調患者,他們接受安慰劑(52名)或Skyclarys 150毫克(51名)48周。在研究參與者中,53%為男性,97%為白人,研究開始時的平均年齡為24歲。9名(18%)患者年齡小於18歲。
主要終點是評估第48周時與安慰劑相比,改良弗裏德裏希共濟失調評定量表(mFARS)評分的變化。mFARS是一種衡量疾病進展的臨床評估,即吞咽和言語(延髓)、上肢協調性、下肢協調性和直立穩定性。
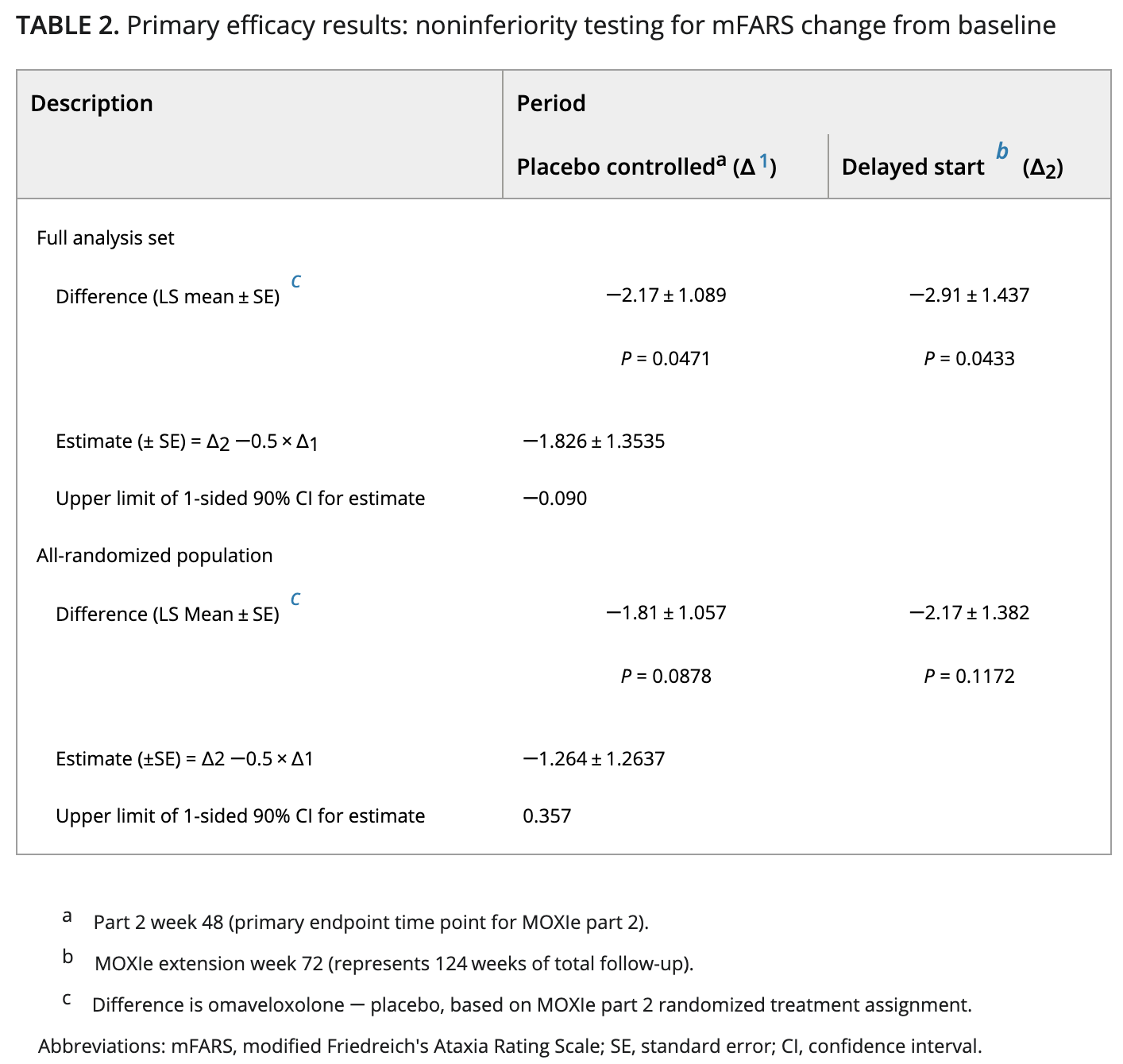
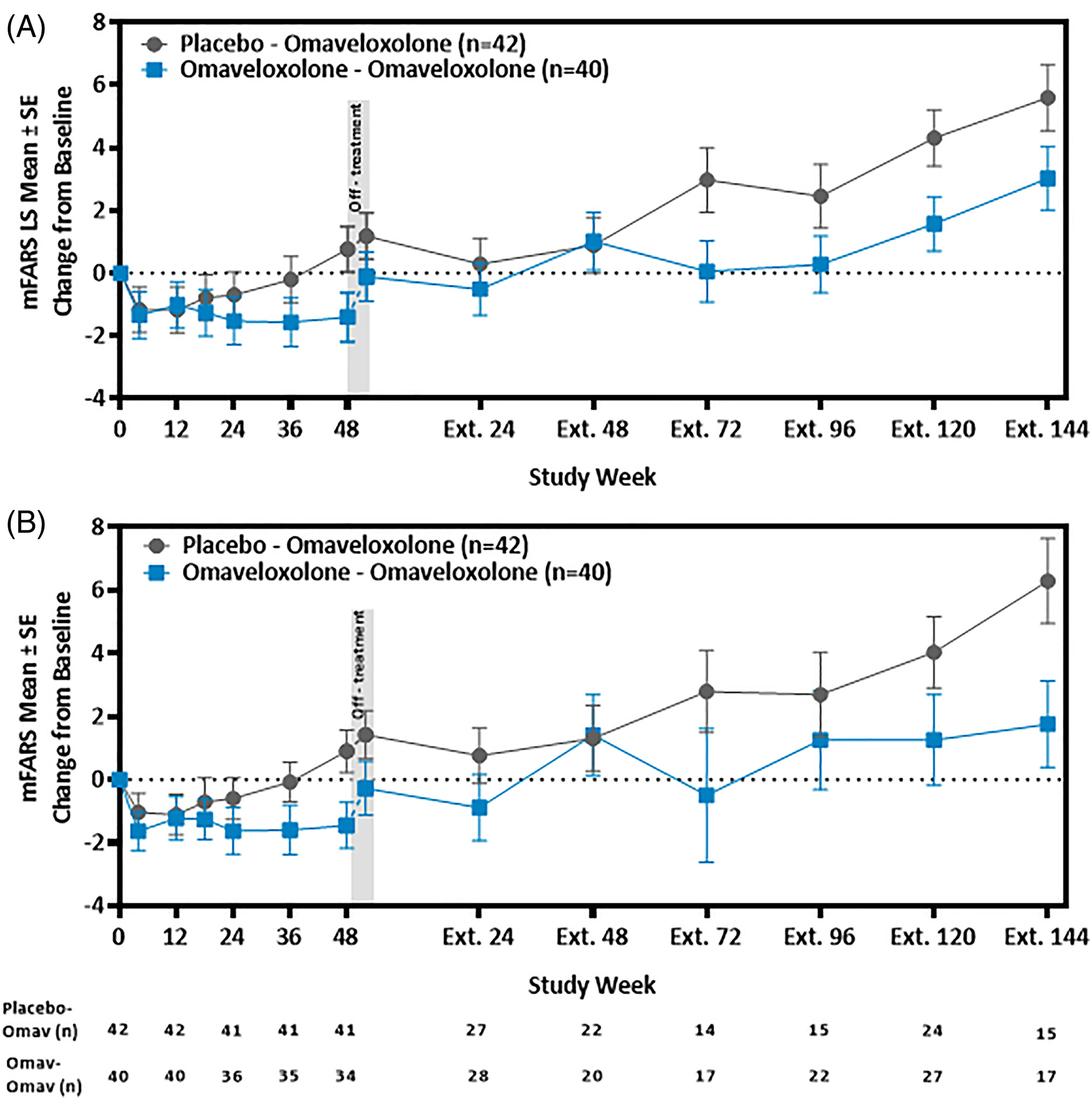
Reata報告的結果顯示,與初始測量相比,評分平均有統計學意義的顯著改善,而安慰劑組患者的評分則有所下降。
此外,對繼續參加非盲研究長達三年的患者數據進行的事後分析顯示,與未接受治療患者的自然病史相比,mFARS評分更好。
臨床試驗中,常見的不良反應包括肝酶升高,這可能是藥物毒性的信號。報告的其他副作用有頭痛、惡心、腹痛、疲勞、腹瀉和肌肉疼痛。該藥物的標簽上沒有黑框警告,但它建議臨床醫生在開始治療患者之前獲取肝酶水平,並在治療期間監測這些水平。
Skyclarys的批準附帶有上市後要求。Reata製藥必須進行額外的檢測,以評估對心髒的風險以及潛在的藥物相互作用。該公司還必須進行哺乳研究,以評估對母乳的影響,盡管Skyclarys的標簽上注明,沒有數據表明母乳中存在該藥物或其成分。此外,該公司表示將進行一項長期的真實世界研究,以進一步評估Skyclarys的安全性。
什麼是弗裏德裏希共濟失調?
弗裏德裏希共濟失調是一種極其罕見的神經肌肉疾病,比杜氏肌營養不良症或脊髓性肌萎縮症更罕見,是一種遺傳性疾病,由編碼共濟蛋白(frataxin蛋白)的FXN基因突變引起。
這種蛋白質對線粒體的功能很重要,線粒體是細胞的能量來源。弗裏德裏希共濟失調主要影響神經係統,低共濟蛋白水平會導致脊髓和周圍神經中的神經纖維變性。症狀可能包括平衡和協調問題、肌肉無力以及手臂和腿部感覺喪失。
該疾病發作通常發生在兒童期或青春期,但在極少數情況下,症狀可能要到成年才出現。患者患心肌病的風險增加,心肌病是一種心肌變弱和擴大的疾病。患者還可能出現視力和聽力問題、脊柱側凸和糖尿病。
這種疾病以常染色體隱性方式遺傳,意味著一個人必須繼承2個突變基因拷貝,每個父母各1個,才能患上該疾病。建議受弗裏德裏希共濟失調影響的家庭進行遺傳谘詢,以了解該病的遺傳模式。