自身免疫性溶血性貧血(AIHA)發現已有150年,其診斷、預後與治療仍然極具挑戰,這是因為對AIHA的發病機製理解並不充分,也缺少證據充分的標準治療。美國Go教授在BLOOD雜誌上發文,以4份病例介紹了AIHA的診斷與治療,同時介紹了有預後意義的指標和MAYO診所的AIHA診斷流程。
一、AIHA簡介
AIHA是由紅細胞抗體引起的紅細胞過度溶解,抗體多為IgG,可固定補體;直接抗球蛋白試驗(DAT)主要是檢測紅細胞表麵抗體,出現肉眼可見紅細胞聚集為陽性;增強DAT敏感性增加,用於診斷非肉眼可見聚集,這對標準DAT陰性AIHA尤為重要,具體見表4。
AIHA發生率3/100000/年,多數為溫抗體,少部分為冷抗體,原發AIHA約占50%,繼發AIHA多與B細胞惡性疾病、自身免疫病或藥物有關。
溫抗體AIHA(WAIHA)和冷凝集素病(CAD)的血清學評估
圖1為WAIHA和CAD時紅細胞膜上典型的抗體和補體模式,多數WAIHA抗體為IgG,CAD為IgM,IgA雖少見,但溶血非常嚴重。抗體與紅細胞上抗原的最佳結合溫度是診斷冷、溫抗體AIHA的主要指標,分別為<4度和37度。
治療啟動後的最初幾周內要監控Hb和RET水平,DAT檢查為常規,不過有時疾病已控製DAT仍為陽性。溶血程度與骨髓紅係增生多平行,偶爾嚴重溶血時網織紅細胞反而減低,此時使用促紅素可能有效。
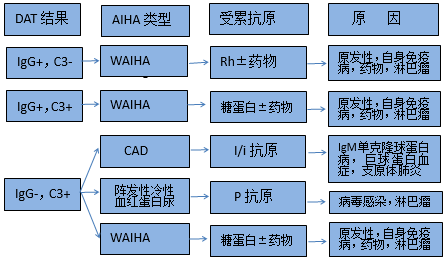
圖1 AIHA血清學表現與病因
▲ 病例1 原發性WAIHA
68歲女性因疲勞就診,Hb93g/L,MCV89.7 fL ,RET119×109/L ,肝結合珠蛋白<14 mg/dL,LDH267U/L ,TBIL0.8mg/dL,血塗片紅細胞嗜多染,DAT 抗IgG++,抗C3弱陽性。
1.是否應常規評估淋巴係統惡性疾病?
研究顯示48%患者的繼發因素同時或先於AIHA存在,8%發生於AIHA之後,最常見的是淋巴瘤或意義不明淋巴增殖性疾病、自身免疫病,因此新診斷患者應CT檢查胸腹盆腔並骨髓活檢,如發現繼發疾病,治療上可能就不僅僅是激素,聯合其它治療將改善治療反應減少複發。
2.如何使用糖皮質激素?
經驗性認為糖皮質激素是WAIHA的一線治療,可減少抗體產生,降低抗體親合性,減少紅細胞脾髒破壞,降低Fcγ受體。最多采用的強的鬆劑量1.0-1.5 mg/kg/天,至少2周,直至Hb>12g/dL,然後每周減量20mg,至20mg/天後緩慢減量,至少4-8周,每周測定Hb,直至完成減量,此後可降低檢查頻度。高劑量地塞米鬆40mg/天×4也是一種選擇,但需要進一步研究。激素治療同時要補充葉酸1mg/天。
3.脾切除的價值
脾切除有效率60%-90%,1/3複發,多發於術後1-2月內,無繼發因素者反應率更高,雖然利妥昔單抗作用越來越得到肯定,但脾切除仍是原發性AIHA的主要二線選擇,對有繼發因素者利妥昔單抗和疾病特異性治療可能是更好選擇。脾切除前後2周內應行疫苗接種。
4.如何治療複發難治AIHA
現無難治複發AIHA的標準定義,如下情況應考慮後線治療:(1)>20mg/天強的鬆才能控製溶血;(2)明確的臨床複發;(3)不耐受。強的鬆減量時,溶血雖存在,但可良好代償時不考慮二線治療,DAT轉陰也不是溶血控製的必要條件。
表1為二線治療常用方案,利妥昔單抗最常使用,是脾切後複發的一線選擇,OR和CR分別為79% 和42%,原發和繼發AIHA的OR率相似,複發率50%,複發後利妥昔單抗再治療仍有效。其它藥物的研究很少,MAYO多選用免疫抑製劑,治療反應需數月,至少治療8-12周。
表1 複發難治WAIHA治療選擇
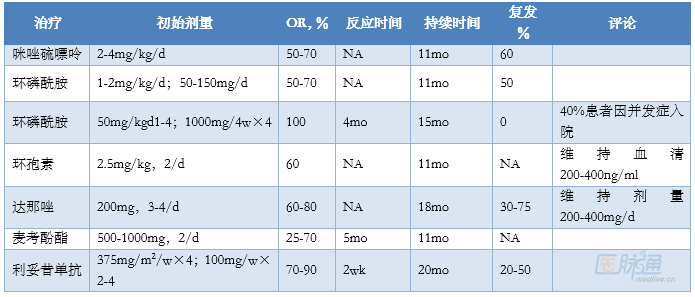
▲
62歲男性CLL患者,因疲勞就診。Hb5.8g/dL,MCV 93.5 fL,,WBC 4.0×109/L,PLT50×109/L,Ly1.6×109/L,RET10×109/L,肝結合珠蛋白<14 mg/dL,LDH 420 U/L,TBIL2.0 mg/dL,IBIL1.5 mg/dL,血塗片紅細胞嗜多染。DATIgG++, 1年前氟達拉濱+環磷酰胺+利妥昔單抗治療獲PR。
1.紅細胞輸注適應症、禁忌症和注意事項
血流動力學穩定者Hb<7g/dL時考慮輸注,因貧血出現心肺症狀時輸血不根據Hb水平。為了安全輸注,需要紅細胞表型匹配,表型檢查應在輸血前或末次輸血後3個月進行,即便表型匹配,輸注後紅細胞生存仍然縮短。目前沒有紅細胞輸注的絕對禁忌症。
2. 是治療CLL還是AIHA,還是二者兼顧?
首先明確有無CLL治療適應症,如果需要化療,應使用含非嘌呤類似物的方案和依魯替尼, AIHA通常對CLL治療有反應;如果沒有CLL治療適應症,此時治療同常規AIHA治療。
3. 氟達拉濱治療時AIHA的發生頻度
未接受過治療者AIHA發生率為2%,接受過氟達拉濱治療者為6%,大部分溶血發生於前3個治療周期內,通常需要輸血治療,有時為致死性。如果發生AIHA,通常要停用氟達拉濱,尤其嚴重溶血時。噴妥司汀和克拉屈濱也與AIHA相關,應避免。
如果CLL不需要進一步化療,單獨糖皮質激素治療,如果仍需治療,優選利妥昔單抗/環磷酰胺/地塞米鬆,苯達莫司汀/利妥昔單抗或新的信號抑製劑,上述方案可有效治療激素耐藥AIHA,多數病例的CLL和溶血均可持續控製。正在接受AIHA治療者,如果開始依魯替尼治療,可在5個月內停止AIHA治療。
4. 最近批準的CLL新藥是否可產生AIHA
新獲批的CLL新藥包括依魯替尼、艾代拉裏斯、obinutuzumab、奧法木單抗和venetoclax,暫無證據顯示AIHA風險增加,不過依魯替尼治療時預先存在的免疫性血細胞減少會出現再燃現象,免疫性血細胞減少在治療的2-8周內加重,繼續治療,不論是否加用激素,現象可控。
▲
54歲男性,急性氣管炎,阿奇黴素治療,因疲勞就診。Hb11.4g/dL,MCV 100 fL,RET266×109/L,肝結合珠蛋白<14 mg/dL, LDH 295 U/L,TBIL1.3 mg/dL,IBIL1.0 mg/dL,血塗片紅細胞聚集,DAT抗IgG弱陽性,抗C3+++ ,電泳見小量IgMκ單克隆抗體,血清肺炎支原體改變與病史相符,冷凝集素滴度>512。
1. 診斷時應進行哪些血液惡性疾病檢查
50%有自身免疫病或感染參與溶血,其餘多與潛在克隆性B細胞疾病相關。研究顯示CAD中34%患者為B細胞淋巴瘤,47%為MGUS,其中95%為IgMκ,其它包括IgGλ 或IgAλ。因此應常規淋巴瘤檢查,尤其無明顯感染時,包括CT和骨髓活檢。
2. 哪些患者需要治療?
避免冷暴露適用所有患者,包括穿衣,室內溫度高於溶血溫度,避免冷飲和冷水浴,住院治療時使用保溫毯,靜脈輸液和輸血應預熱。對有明顯症狀和體征的患者應全身治療,包括雷諾氏現象、貧血或溶血導致的後遺症。與感染有關CAD通常自限,無需治療,但要治療潛在淋巴增殖性疾病。
3. 利妥昔單抗的有效性
雖缺少隨機研究,但目前認為利妥昔單抗是CAD一線治療, ORs 在45% -54% ,中位反應時間1-2月,中位反應持續時間8-11個月,CR<5%,無論是否存在繼發因素反應率相似。與強的鬆聯合,治療反應時間、CR率和複發率均明顯改善,提示二者有疊加作用。375mg/m2/周×4和100mg/周×4均有效。
3. 糖皮質激素是否有效?
以往研究顯示激素治療反應率<15%,但近期研究發現激素應用很常見,反應率也不像報道那樣低,隻是維持治療量高於WAIHA,對IgG冷凝集素的長期有效性更好。
4. 脾切除的價值
CAD通常不推薦脾切除,因為紅細胞損壞主要發生在肝髒,不過有研究顯示3/11冷凝集素患者脾切有反應,持續時間5-15個月, IgG冷凝集素可能從脾切中獲得持續治療反應。
5. 複發難治病例的治療
CAD的其它治療有效性數據很少,表2對相關數據進行了總結。用於WAIHA的免疫抑製劑和細胞毒藥物有效性低,克拉屈濱和咪唑硫嘌呤幾乎無效,可能有效藥物包括硼替佐米、利妥昔單抗/苯達莫司汀、艾庫組單抗、利妥昔單抗/環磷酰胺和利妥昔單抗/氟達拉濱/環磷酰胺。
表2 複發難治CAD的治療選擇
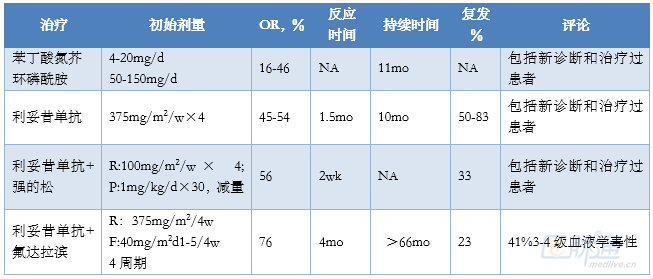
▲
50歲男性因疲勞、黃疸就診,否認飲酒史、病毒性肝炎風險因素、近期旅遊史、毒物暴露史、服藥史。體檢見黃疸和肝脾大。Hb6.0g/dL,RET272×109/L,PLT245×109/L,LDH 1000U/L,肝結合珠蛋白<14 mg/dL,TBIL 6.3 mg/dL,IBIL4.7 mg/dL,2次DAT 均陰性,無PNH克隆,血塗片球形紅細胞明顯增多,骨髓活檢顯示紅細胞明顯增生。因有症狀貧血,輸注4U紅細胞,Hb升至10.0g/dL,但24小時內降至7.5g/dL。高度懷疑WAIHA,行增強DAT發現低親合力IgG抗體。
1. DAT陰性WAIHA發生頻率
3%-11% WAIHA為DAT陰性,這將影響診斷與治療。最常見DAT陰性原因是技術性的,10%-50%的患者如果在標準實驗室檢查則為陽性,DAT陰性和陽性患者的臨床表現和治療反應相似。
2. 如何檢測DAT陰性AIHA ?
標準DAT檢查陰性的原因見表3,增強DAT可以檢測表3所列機製,常見增強DAT檢查見表4。
表3 標準DTA陰性WAIHA機製

表4 增強DAT
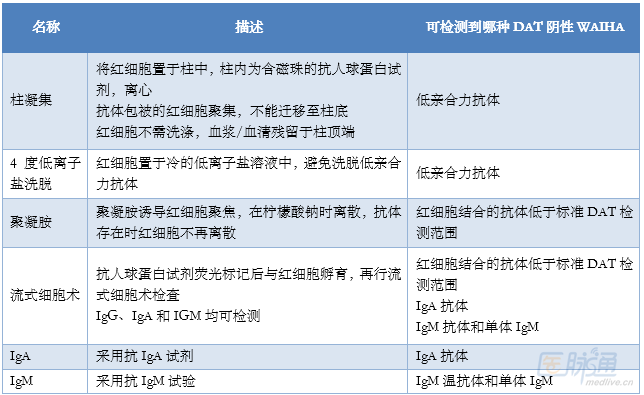
挑戰
AIHA的病因仍不完全清楚,標準DAT陰性時需進行增強DAT檢查,明確是溫還是冷抗體對明確病程和治療十分重要,要注意尋找導致AIHA的潛在因素。目前有臨床研究正在探討新的治療手段。