作為最常見的消化係統惡性腫瘤之一,肝細胞癌(HCC)已成為全球癌症相關死亡的第四大原因,是嚴重威脅人類健康的重大疾病[1]。
肝癌的發病過程涉及眾多異常表達的基因及相應信號通路,目前研究已表明基因表達的RNA轉錄後調控異常是導致肝癌的重要機製[2]。
可變剪接(AS)是一種常見的轉錄後調控方式,通過對同一mRNA前體pre-mRNA的不同剪切及拚接,可以產生不同的mRNA剪接異構體,進而影響下遊蛋白產物的結構或功能,大大增加蛋白質功能的多樣性[3]。
異常的可變剪接是腫瘤異質性產生的重要原因,同時在維持腫瘤增殖、遷移、侵襲以及治療耐藥中發揮重要作用[4, 5]。可變剪接過程主要由剪接因子調控,其中富含絲氨酸/精氨酸蛋白(SR)家族是主要的可變剪接激活蛋白,其異常表達可能在腫瘤發生發展中發揮不同作用[6]。
實際上,SR蛋白家族的不同成員,如SRSF1、SRSF2、SRSF3、SRSF5、SRSF9等已經被證實在肝癌進展中扮演著不同的角色[7-9]。然而,作為該蛋白家族成員之一的SRSF10在腫瘤發生中的潛在功能仍然不為我們所知。
近日,中南大學湘雅三醫院曹科團隊在著名期刊Journal of Experimental and Clinical Cancer Research發表了一項研究成果[10]。
他們發現SRSF10在肝癌中表達水平升高,並與不良預後相關。從機製上講,SRSF10可通過調節細胞周期調節因子CDC25A的可變剪接,刺激肝癌細胞的增殖、侵襲,明確了SRSF10對於肝癌惡性表型的促進作用。

論文首頁截圖
研究人員首先基於公共數據庫以及臨床樣本,分析了SRSF10在HCC及癌旁正常組織中的表達差異。
他們發現SRSF10在HCC中高表達,並與患者不良預後相關。他們還證實SRSF10可以促進肝癌細胞Hep3B和HepG2的增殖、侵襲等惡性生物學行為,並且細胞周期調節因子CDC25A可能是SRSF10調節的關鍵下遊因子。
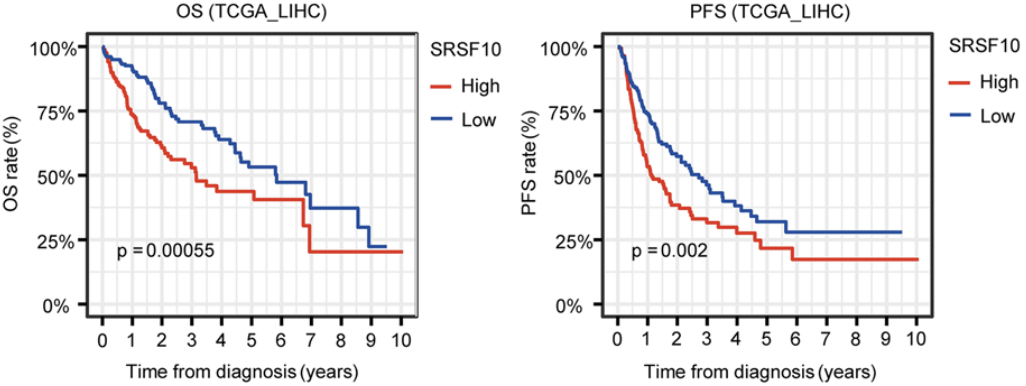
SRSF10與患者不良預後相關
至於SRSF10促進肝癌的具體作用機製。曹科團隊發現,SRSF10可通過其RNA結合結構域與CDC25A pre-mRNA結合,發揮剪接作用,上調肝癌細胞中外顯子6缺失的CDC25A mRNA亞型(CDC25A △E6)表達。
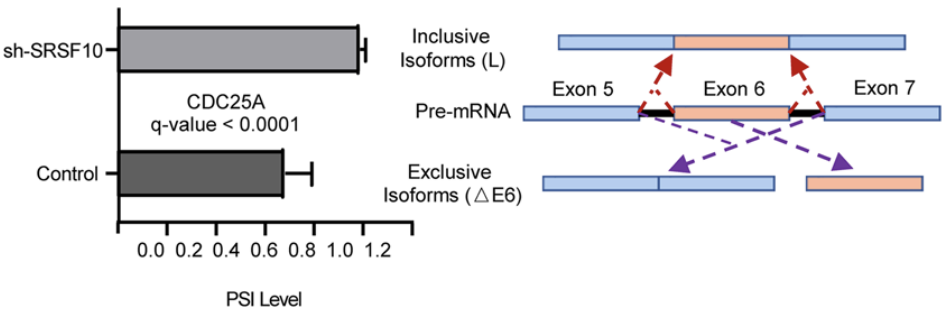
SRSF10調節CDC25A △E6亞型的表達
之前的研究表明,CDC25A是CDC25家族中的重要成員,具有磷酸酶活性,可以激活細胞周期依賴性蛋白激酶(CDK),在細胞周期轉換及有絲分裂過程中起重要作用,是癌症治療的潛在靶標[11]。
那CDC25A △E6亞型與未經剪切的longer CDC25A(CDC25A L)在生物學功能上有何差異呢?曹科團隊在敲低內源CDC25A的肝癌細胞中分別回補CDC25A(△E6)及CDC25A(L),結果顯示與CDC25A(L)相比,CDC25A(△E6)對肝癌細胞增殖、侵襲等惡性生物學行為的促進作用更顯著。這表明CDC25A(△E6)具有更強的腫瘤促進作用。
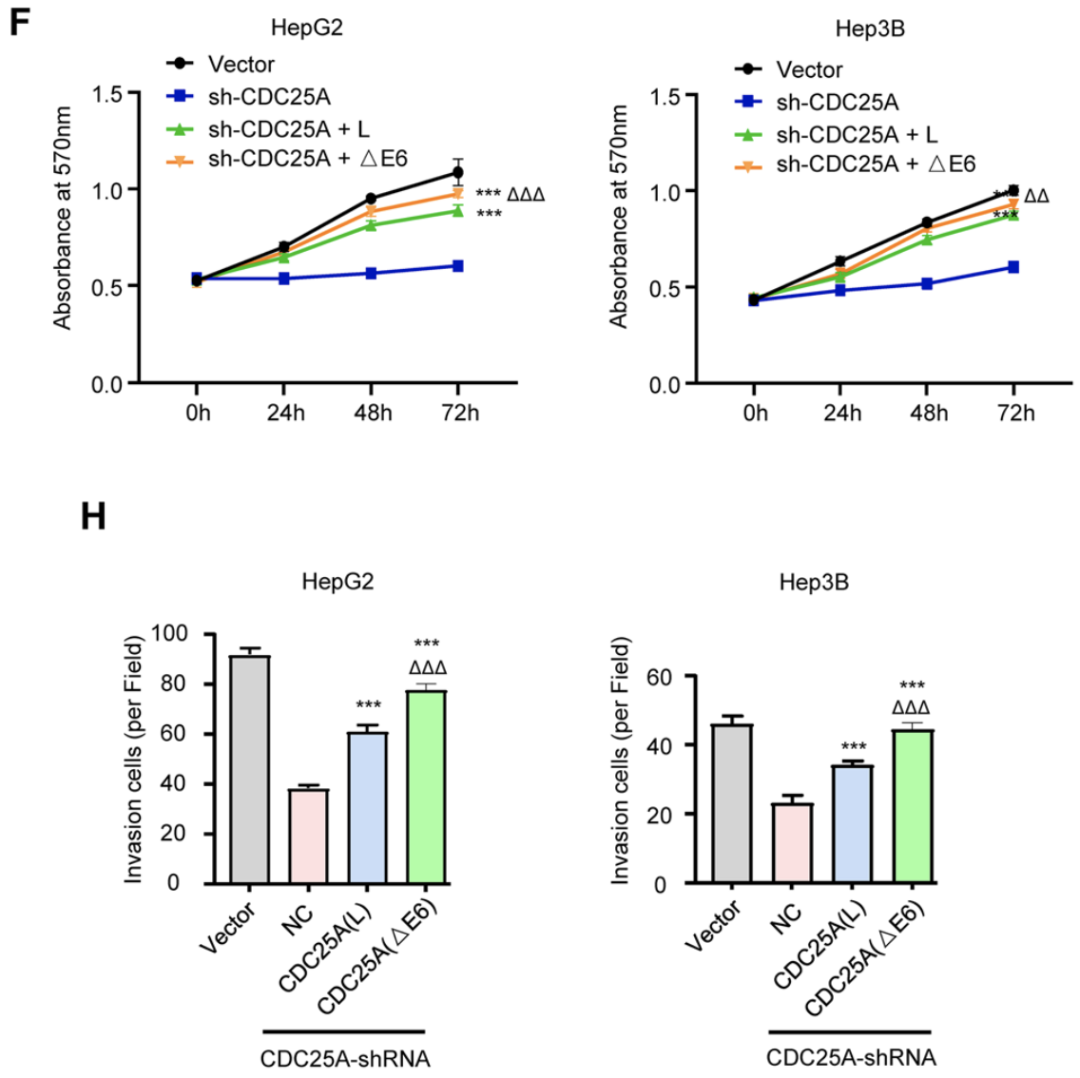
CDC25A(△E6)具有更強的腫瘤促進作用
與CDC25A(L)蛋白主要集中於細胞質不同,CDC25A(△E6)蛋白則主要在細胞核中表達,這是因為外顯子6編碼的蛋白區域(144-183aa)包含磷酸化修飾位點(S178),該位點表達的缺失導致CDC25A(△E6)磷酸化水平的下調並增加了其細胞核定位,從而發揮更強的細胞周期調節作用,促進腫瘤惡性進展。
此外,外顯子6的缺失還會導致CDC25A(L)的兩個泛素化修飾位點K150和K169的缺失,從而導致CDC25A(△E6)的泛素化修飾水平下調,蛋白質穩定性升高,表達水平上調。
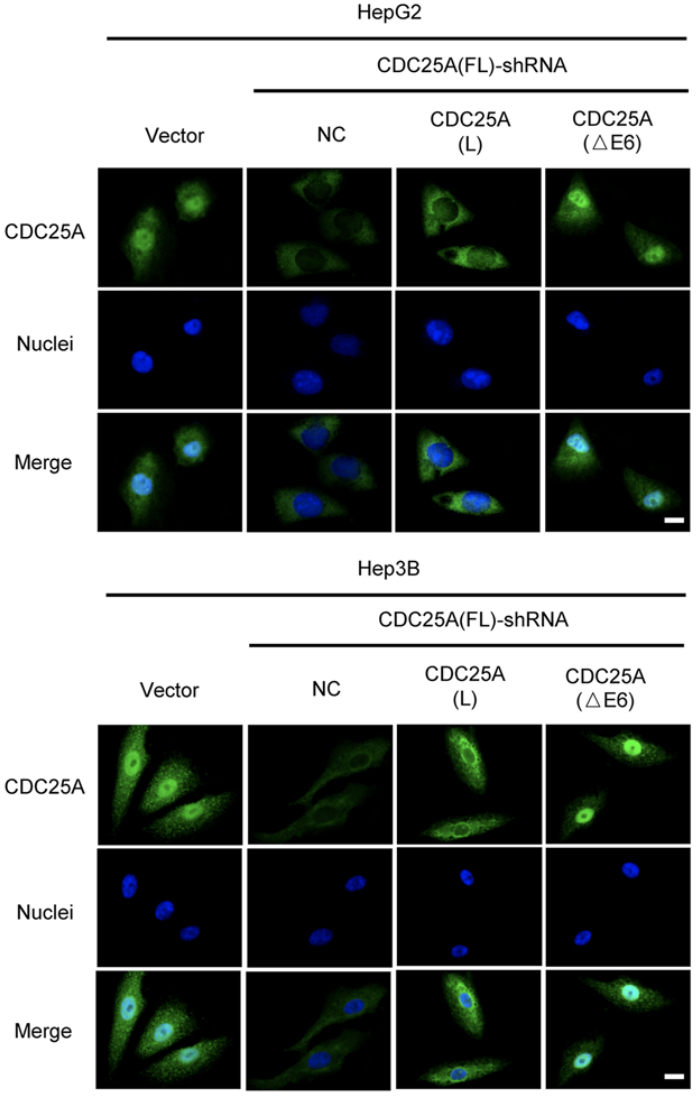
CDC25A外顯子6表達的缺失影響其細胞定位
由此,研究人員證明,CDC25A外顯子6的可變剪接,導致了泛素化和磷酸化位點的缺失,提高了CDC20A(△E6)的穩定性並促進了其在細胞核的積累,從而發揮了更強的促癌作用。
最後,研究人員在SRSF10過表達的細胞中分別敲低CDC25A(L)和CDC25A(△E6)。結果顯示,與敲低CDC25A(L)相比,敲低CDC25A(△E6)對腫瘤的惡性表型具有更為顯著的抑製作用。
同時,HepG2細胞的異種移植模型也顯示:與CDC25A(L)相比,CDC25A(△E6)具有更強的促進腫瘤生長的作用。這進一步證明CDC25A的外顯子6的剪切是SRSF10介導的HCC的惡性表型的關鍵下遊機製。
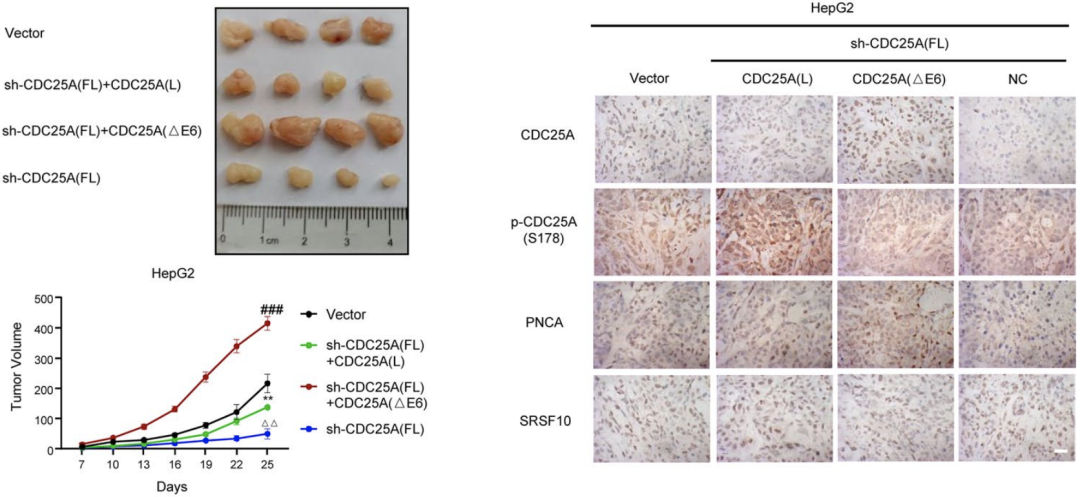
與CDC25A(L)相比,CDC25A(△E6)具有更強的促進腫瘤生長的作用
總的來說,本研究不僅證實了SRSF10對HCC惡性進展的促進作用,更重要的是發現了CDC25A的可變剪接亞型CDC25A(△E6),並證明其具有更強的促腫瘤作用。為CDC25A這一經典的促癌因子在腫瘤中的表達調控機製提供了新的見解,有助於推動該靶點相關抑製藥物的開發及應用。