
範建高教授
在第51屆歐洲肝病研究學會(EASL)年會召開期間,首部歐盟國家《NAFLD臨床實踐指南》在大會上發布,該指南由EASL、歐洲糖尿病研究學會(EASD)和歐洲肥胖研究學會(EASO)聯合製訂,指南原文在線發表於《肝髒病學雜誌》(J Hepatol)。我們邀請上海交通大學醫學院附屬新華醫院消化內科範建高教授對指南內容進行呈現與點評。
指南發布背景
隨著肥胖、糖尿病和代謝綜合征的全球化流行,近20餘年非酒精性脂肪性肝病(NAFLD)及其嚴重類型——非酒精性脂肪性肝炎(NASH)已成為慢性肝病愈來愈重要的病因,嚴重危害公眾健康。
為提高廣大醫生對NAFLD和NASH的診斷治療水平,規範脂肪肝及其相關疾病的診療行為,中國(2006和2010年)、亞太地區(2007年)、意大利(2010年)、歐洲(2010年)、美國(2012年)、韓國(2013年)、世界胃腸病學會(2014年)、日本(2015年)等相關學術團體相繼製定了NAFLD診療指南或專家共識;英國移植學會於2012年製定了NASH患者肝移植指南;加拿大和澳大利亞相關學術組織則分別於2007年和2013年製定了全科醫生脂肪性肝病診療指南;此外,2013年我國還出台了《脂肪性肝病診療規範化的專家建議》。以上這些指南或共識意見對於所在國家和地區脂肪性肝病的篩查、診斷、評估、防治和隨訪起到了巨大的推動作用。
4月6日,首部歐盟國家《NAFLD臨床實踐指南》問世,與以往指南製定專家和機構均來自消化病學會和肝病學會不同,該指南由EASL、EASD和EASO三個不同領域學會聯合製訂。該指南對NAFLD的篩查、診斷、治療和隨訪共提出38條推薦意見,主要針對成年患者,但對兒童NAFLD的診治亦提出一些建議。
這些推薦意見在EASL 2009年NAFLD專題研討會紀要的基礎上,參考了截至2015年4月的最新研究結果,根據證據等級和推薦強度以及地方法規等製訂。因此,該指南反映了NAFLD臨床研究領域的新進展、新技術和新理念。
指南亮點提要
與原有國外指南相比,該指南強調需要在肥胖、糖尿病和代謝綜合征患者中篩查NAFLD或NASH,強調對於NAFLD患者評估人體學指標(身高、體重、腰圍及血壓等)以及代謝(包括糖尿病)與心血管危險因素的重要性,這與我國2010版指南推薦內容相似,但增加了一些循證依據;該指南首次將NAFLD根據有無肥胖、有無胰島素抵抗(IR)以及有無遺傳易感性進行亞組分析。
盡管該指南提出磁共振波譜分析(1H-MRS)是定量肝髒脂肪的金標準,也談到肝髒瞬時彈性檢測在評估肝纖維化和脂肪肝中的作用,但是仍將超聲作為首選方法用於脂肪肝的診斷,將肝髒活檢作為判斷NASH和進展性肝纖維化的唯一方法,建議應用肝脂肪變性、炎症、纖維化評分(SAF)代替NAFLD活動性積分(NAS)。
該指南強調對於NASH、特別是合並進展性肝纖維化的患者,必須給予針對肝病的藥物幹預,並認為合並2型糖尿病、代謝綜合征、丙氨酸氨基轉移酶(ALT)持續增高等的NAFLD患者需要接受藥物幹預,這同樣與我國2010版指南的精神相似,區別在於本次推薦用藥為吡格列酮(療效似乎可靠,但僅限用於合並2型糖尿病患者)、維生素E(短期治療耐受性和安全性較好)或二者聯用,關於療程隻提出藥物治療半年以上轉氨酶不下降者需要停藥,而對於藥物治療有效或轉氨酶不高的患者未提出推薦意見,這部分患者的肝病用藥有可能會像降糖藥、降脂藥、降血壓藥那樣需要長期應用。
■鏈接

指南推薦內容
NAFLD定義
(1)合並IR和(或)代謝危險因素(如肥胖或代謝綜合征)的患者,需要通過評估肝髒是否有過度脂肪沉積判斷是否存在NAFLD(A1)。
(2)對於單純性脂肪肝患者需要評估是否存在繼發性NAFLD,包括詳細的酒精攝入情況調查;應當重視中等程度的酒精攝入與代謝危險因素在脂肪肝發病中的交互作用(A1)。
(3)其他慢性肝病患者合並NAFLD可能會導致更嚴重的肝髒損傷的發生(B1)。
患病率與發病率
(4)所有單純性脂肪肝患者除檢測肝酶譜外,均應篩查代謝綜合征。
由於NAFLD是不明原因肝酶異常的主要病因,持續性肝酶異常患者均應篩查NAFLD(A1)。
(5)對於肥胖和(或)代謝綜合征患者,均應行肝酶檢測和(或)超聲篩查NAFLD。
對於高風險人群(年齡>50歲、2型糖尿病、代謝綜合征)應進一步評估有無進展性肝髒疾病(如NASH合並肝纖維化,A2)。
發病機製:生活方式與基因
(6)鑒於不健康的生活方式在NAFLD的發生進展中起著重要作用,飲食及運動習慣調查應成為NAFLD篩查的重要組成部分(A1)。
(7)PNPLA3 I148M和TM6SF2 E167K基因變異與IR及代謝綜合征並不相關,具有此類變異的NAFLD患者可能具有更高的肝髒脂肪含量及NASH患病風險。基因分型可用於特定患者或臨床研究,但不推薦作為常規檢測(B2)。
非侵入式診斷
脂肪變性
(8)NAFLD影像學診斷首選腹部超聲檢查,因為可提供更多診斷信息(A1)。
(9)當無法獲得影像學診斷結果時(例如大型流行病學調查),血清標誌物和相關指數是可接受的診斷肝脂肪變性的替代指標(B2)。
(10)1H-MRS是唯一可以定量評估肝髒脂肪含量的無創手段,可用於臨床試驗和實驗研究。但因其價格昂貴,不推薦用於日常臨床診療(A1)。
NASH
(11)NASH肝髒活檢組織學診斷依據是肝脂肪變性伴肝細胞氣球樣變性和小葉內炎症(A1)。
肝纖維化
(12)血清標誌物、肝纖維化積分及瞬時彈性測定可用於進展期肝纖維化或肝硬化低危人群無創診斷(A2),聯合使用這些無創措施可提高診斷準確性並減少診斷性肝髒活檢的使用(B2)。
(13)臨床上可通過血清標誌物(或評分係統)和瞬時彈性成像技術聯合檢測肝纖維化進展,但其準確性有待進一步證實(C2)。
(14)通過血清標誌物(或評分係統)和(或)瞬時彈性檢測診斷進展期肝纖維化或肝硬化的準確性較低,需要進一步進行肝髒活檢證實(B2)。
(15)對於肝髒疾病進展較快的高危患者,隨訪監測方法必須包括至少5年1次的再次肝髒活檢(C2)。
兒童NAFLD非侵入式檢查
(16)瞬時彈性成像技術、聲脈衝輻射力成像技術(ARFI)以及血清標誌物有助於預測兒童肝纖維化,並減少肝髒活檢的使用(B2)。
NAFLD相關常見代謝紊亂
(17)胰島素評價指數穩態模型評估法(HOMA-IR)是評估無糖尿病患者群IR的替代方法,如已有適宜的參考值範圍則可被推薦用於臨床(A1)。
(18)對於合並代謝危險因素的患者,HOMA-IR對NAFLD診斷的幫助作用有限;對於不明原因的脂肪肝個體,例如肝超聲診斷為脂肪肝但患者體重正常,HOMA-IR能夠證實胰島素敏感性改變,因而有助於IR相關NAFLD的診斷(B2)。
(19)HOMA-IR有助於隨訪期間特定病例NASH或肝纖維化進展風險的評估,體重下降伴HOMA-IR改善預示代謝性危險因素改善,有利於NAFLD病情改善(C2)。
肥胖
(20)肥胖是IR相關NAFLD的主要表型和疾病進展危險因素,因此需要加強對肥胖患者的隨訪(A1)。
(21)雖然大多數較瘦NAFLD患者較超重NAFLD患者代謝紊亂程度弱,但其仍存在IR和體內脂肪異常分布,可能發生疾病進展,因此同樣需要隨訪(B2)。
糖尿病
(22)NAFLD患者需要通過空腹(或隨機)血糖或糖化血紅蛋白(HbA1c)篩查糖尿病(A1),糖尿病高危人群應盡量行標準口服75 g葡萄糖耐量試驗(OGTT)(B1)。
(23)2型糖尿病患者不論肝酶是否正常,均應證實有無NAFLD,因為糖尿病是肝病進展的高危因素(A2)。
診斷評估方案及隨訪(表2、圖)

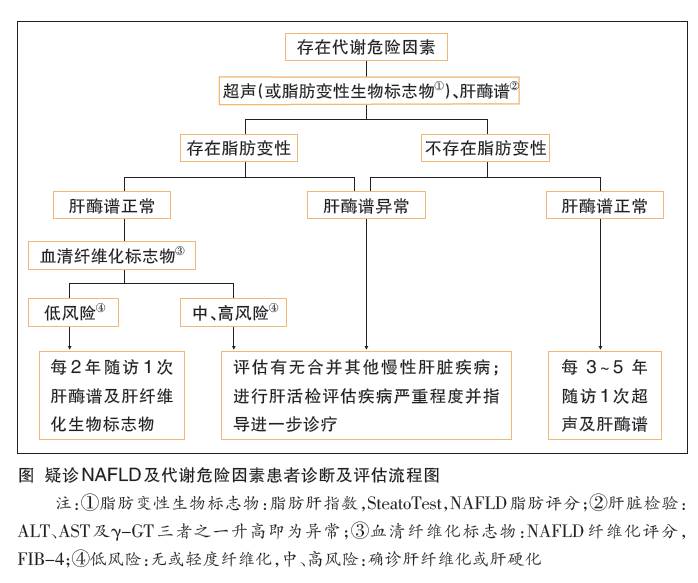
自然病史及並發症
疾病進展
(24)合並高血壓的NASH伴肝纖維化患者是疾病進展的高危人群,故應對此類患者進行密切隨訪(B1)。
心血管疾病
(25)心血管事件是影響NAFLD患者預後的主要因素,因此應對所有NAFLD患者進行心血管係統篩查,至少應做到對患者心血管事件風險進行評估(A1)。
肝細胞癌
(26)肝細胞癌可發生於尚未進展至肝硬化的NAFLD患者,NAFLD是肝細胞癌的危險因素,且PNPLA3 rs738409(C>G)基因多態性可增加這種危險,但目前對肝細胞癌的篩查時機及成本效益尚無推薦意見(B1)。
治療
飲食及生活方式改變(表3)
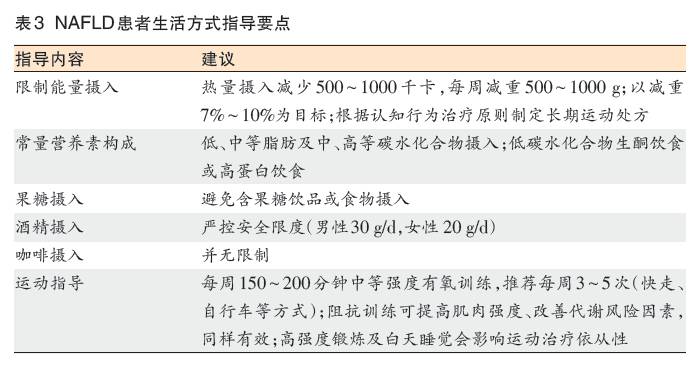
(27)提倡為NAFLD患者提供針對健康飲食和運動習慣、旨在改變生活方式的計劃性課程(C2)。
(28)不伴有肝損傷或肝纖維化的NAFLD患者無需接受針對肝病的藥物治療,通常僅需通過飲食指導及體育鍛煉改善肝髒脂肪沉積(B2)。
(29)對於超重或肥胖的NAFLD患者,建議減重7%~10%以實現肝酶及肝組織學改善(B1)。
(30)飲食指導應該兼顧限製熱量攝入和避免NAFLD促進因素(如加工食品、高果糖添加食品),可以根據地中海飲食結構對營養素比例進行調整(B1)。
(31)有氧訓練及阻抗訓練均可以降低肝髒脂肪含量,可根據患者嗜好、以能夠長期堅持為原則選擇訓練方式(B2)。
藥物治療
(32)NASH患者,特別是肝纖維化分期≥F2的患者應接受藥物治療。對於病情較輕但疾病進展高風險人群(如合並糖尿病、代謝綜合征、持續性ALT升高、炎症壞死水平嚴重),也應考慮給予藥物治療以預防疾病進展(B1)。
(33)目前並無明確的藥物被推薦用於NAFLD的治療,吡格列酮(療效似乎可靠,但僅限用於合並2型糖尿病的患者)、維生素E(短期治療的耐受性和安全性較好)或二者聯合可用於NASH患者的治療(B2)。
(34)目前尚未明確藥物治療的最佳療程。對於ALT高於正常上限的患者,若藥物治療6個月ALT無明顯下降則應停止治療;對於ALT正常人群,藥物治療的療程尚未明確(C2)。
(35)他汀類藥物可用於降低低密度脂蛋白膽固醇(LDL-C)水平,並預防心血管事件發生,但並不能促進或改善肝髒疾病。同樣,ω-3多不飽和脂肪酸可降低血清及肝髒脂質水平,但尚無數據表明其對NASH改善有效(B1)。
兒童NAFLD
(36)飲食調整及體育鍛煉可改善兒童NAFLD患者脂肪性肝炎以及肝細胞炎症反應,但對於已經存在的肝纖維化改善並不明顯。目前尚無藥物可以安全應用於兒童NAFLD患者(B1)。
減肥手術
(37)外科減肥手術通過改善肥胖及糖尿病減少肝髒脂肪沉積,並可能延緩NASH進展;前瞻性研究提示,外科手術可以改善包括纖維化在內的NASH患者的組織學表現(B1)。
肝移植
(38)對於終末期肝病的NASH患者,可考慮進行肝移植,雖然其心血管相關死亡率較高,但總體移植成活率同其他肝移植適應證相似。
對出現肝功能衰竭和(或)肝細胞癌的NASH患者可考慮行肝移植(A1)。
小結
由於全球經濟和醫療衛生資源參差不齊,歐洲《NAFLD臨床實踐指南》不可能兼顧全球不同國家和地區NAFLD的診斷、治療和篩查等問題,並且由於相關國家和地區的實際情況以及指南發布時間不同,現有指南在某些問題上存在不同意見。
製訂指南的最終目的是提高對NAFLD及相關疾病患者的診療水平和對NAFLD危害的認知,為衛生政策製定者提供循證依據,從而有助於相關政策的製定。該指南的問世無疑將彌補現有診療指南的不足,並促進我國NAFLD規範化診療的實施和推廣。