近年,惡性腫瘤所致的梗阻性黃疸發病率呈上升趨勢。引流術是治療不能切除病灶所致梗阻性黃疸的常用方法,其中膽道支架介導的內引流是常見的引流方式。然而,如何選擇支架仍備受爭論。對於不可切除的肝門部惡性膽道梗阻的膽道引流,在長期通暢率方麵,非覆膜的自膨式金屬支架優於塑料支架。然而,隨著疾病的進展,仍會出現支架內的再發梗阻。因為非覆膜的自膨式金屬支架並不能阻止腫瘤向支架內生長,反而進一步加大了支架拔出的難度,這對於再次梗阻患者的膽道引流提出了新的挑戰。近期,日本專家發明的新型自膨式全覆膜金屬支架為這一難題提供了新的解決方案。
■研究簡介
日本專家近期發明了一種直徑6 mm的帶線新型自膨式全覆膜金屬支架T-FCSEMS,這種支架可以防止腫瘤向支架內生長,並且即使出現支架內再梗阻,也容易被拔除,該發明旨在解決非覆膜自膨式金屬支架帶來的臨床問題。研究表明,對於肝門部惡性膽道梗阻患者,不論是初步治療,還是在支架內阻塞後進行再次幹預,T-FCSEMS 支架均是頗具前景的選擇。文章發表於《消化內鏡》雜誌8月刊[Gastrointest Endoc2016, 84(2): 352]。
該研究在2014-2015年入組患者30例,初次治療組17例,再次治療組13例。所有患者治療前均行CT、磁共振胰膽管成像(MRCP)、內鏡逆行胰膽管造影(ERCP)檢查,以評估膽道分支類型以及腫瘤的位置和深度。引流的位置是基於上述因素和肝髒萎縮程度來選擇的。一旦確定膽道狹窄為惡性腫瘤所致,將使用8F推送係統將FCSEMS放置在十二指腸乳頭以上並跨過狹窄處(圖1A和1B)。
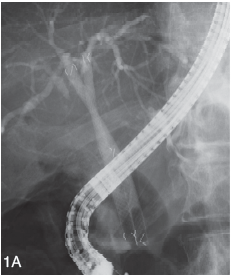
圖1A 左肝管和右肝管內各植入一枚新型自膨式全覆膜金屬支架
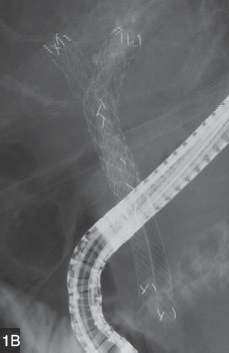
圖1B 應用非覆膜自膨式金屬支架後出現支架內再阻塞,采用支架內放置支架的方法,植入新型自膨式全覆膜金屬支架
根據狹窄的長度,可選擇長度為80 mm 或60 mm 的支架,並將線端留在十二指腸內(圖2A和2B)。

圖2A 新型自膨式全覆膜金屬支架的線端係在十二指腸側
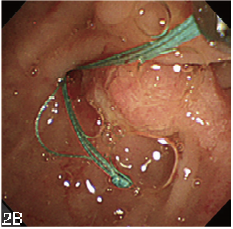
圖2B 線端可以由十二指腸乳頭處拉到十二指腸內
當膽道出現再次梗阻時,可用鉗子拽住線端,將支架拉出至十二指腸,也可以聯合圈套器套住支架,將支架拉入內鏡工作孔道中。
結果顯示,初次治療組的支架植入成功率為94%(16/17),再次治療組成功率為92%(12/13)。初次治療組有2人被診斷為比斯毛特(Bismuth)Ⅲ型或Ⅳ型,支架植入後因後膽管阻塞而發生肝膿腫。支架再梗阻方麵,初次治療組發生率為31%(5/16),再次治療組發生率為75%(9/12)。對於進行了雙側支架植入的患者,再發梗阻的中位時間為210 天,對於再次治療組,中位時間則相對延長。與此同時,內鏡下跨乳頭的再幹預成功率為100%。對於欲拔出T-FCSEMS的患者而言,支架拔出率是100%。綜上,對於肝門部惡性膽道梗阻患者,植入T-FCSEMS是一種有效的治療方法。
■ 專家點評
肝門部惡性膽道梗阻的新選擇
首都醫科大學附屬北京友誼醫院 張澍田
膽道惡性腫瘤的惡性程度較高,一般發現時已為晚期,喪失手術機會,而患者膽道梗阻會使肝功能進行性下降。當梗阻達到一定程度時,肝功能會迅速惡化,如不及時解除,可導致肝衰竭,危及患者生命。因此,及時解除膽道梗阻對於延長患者生命、減少痛苦尤為重要。經皮肝穿刺膽道減壓引流術是梗阻性黃疸重要的治療方法,但是引流管堵塞、皮膚及肝髒感染等在一定程度上製約了該方法的使用。膽道支架的發明及應用因其微創、便捷並且能夠恢複膽汁的生理流向,具有裏程碑式的意義。
對於肝門部惡性腫瘤造成的梗阻,塑料支架及金屬支架各有應用。塑料支架較非覆膜的金屬支架而言,長期通暢率較低,而非覆膜的金屬支架又常因腫瘤的支架內再生長而出現阻塞。全覆膜金屬支架的應用,能否有效延長支架內再阻塞的時間,值得進一步研究。
近期日本專家發明了一種直徑6 mm的帶線新型自膨式全覆膜金屬支架T-FCSEMS,並對其進行了療效、膽道再發梗阻、支架拔除及並發症方麵的研究。該研究發現,直徑6 mm 的全覆膜金屬支架可以預防支架內再梗阻,並且更適合肝門部梗阻的患者;另一方麵,此支架未出現膽管擴張相關的並發症,如門脈栓塞、膽囊炎等。在支架的拔除和再放置方麵,該支架顯示了極大的優勢。同時,對於放置非覆膜金屬支架而出現支架內梗阻的患者,可以再次放置該支架。總之,對於再發梗阻發生率高的肝門部惡性腫瘤所致的膽道梗阻,新型直徑6 mm帶線的自膨式全覆膜金屬支架是一個不錯的選擇。