一般來說,細胞微環境的改變會影響細胞的生長發育、形態變化等,而且這些行為都需要消耗能量,但少有人研究,細胞究竟是如何根據微環境的改變而調整自身的能量使用。近日,UT西南醫學中心的研究者們利用人體肺癌細胞對該問題展開研究,結果發表在《Nature》期刊上。
細胞可以通過骨架蛋白來感知周圍組織的剛度,為了研究能量消耗與組織僵硬之間的相互作用,研究者在堅硬和柔軟的表麵上分別培養正常的肺細胞,代謝產物的測量結果顯示,軟表麵上的代謝產物較少,細胞的能量消耗相對也減少了。
糖酵解增強是癌症的標誌,磷酸果糖激酶(phosphofructokinase,PFK)是葡萄糖代謝所需的關鍵酶。研究者發現,人支氣管上皮細胞從硬表麵到軟表麵的轉移,是通過蛋白酶體降解PFK從而引起糖酵解下調。而PFK的降解又是由應力纖維的分解觸發的,後者可釋放靶向PFK的E3泛素連接酶——tripartite motif (TRIM)-containing protein 21(TRIM21)。之後,研究者發現轉化後的非小細胞肺癌細胞在任何環境下,都能維持較高的糖酵解速率,並通過下調TRIM21、同時將螯合的TRIM21留在對基質剛度不敏感的應力纖維上,從而保持PFK表達。
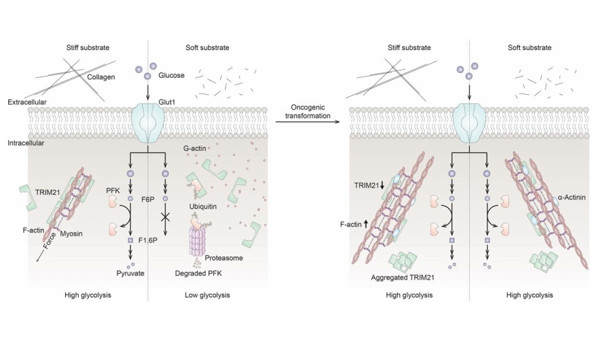
機械調節糖酵解模型
本研究的通訊作者Danuser總結到,這項研究表明,細胞通過PFK的TRIM21降解途徑來機械調節糖酵解,這涉及細胞骨架,並最終影響正常細胞和癌細胞的能量使用。而惡性腫瘤可能是由於癌細胞通過螯合抑製TRIM21所致,使其表現出不隨環境而變的高糖酵解速率。