2023年4月21—22日,一年一度的中國臨床腫瘤學會(CSCO)指南大會在廣州召開。醫學論壇網對大會內容進行了全程報道,本次我們邀請到中山大學腫瘤防治中心陳功教授為我們分享結直腸癌的外科治療的更新內容。
01
▼
基於MMR/MSI狀態製定M0結直腸癌
術前新輔助治療策略
一、cT4b結腸癌
更新:
基於KEYNOTE-177、FOCULM等研究結果,2021年版CSCO指南提出對於局部分期cT4b MSI-H/dMMR結腸癌患者可以考慮新輔助免疫治療,這一建議相交NCCN指南提前了一年左右。
在2023版指南當中,對於這一問題進行了再度細化,正式將新輔助免疫腫瘤(IO)治療將其放入外科手術治療推薦表格的二級推薦部分。
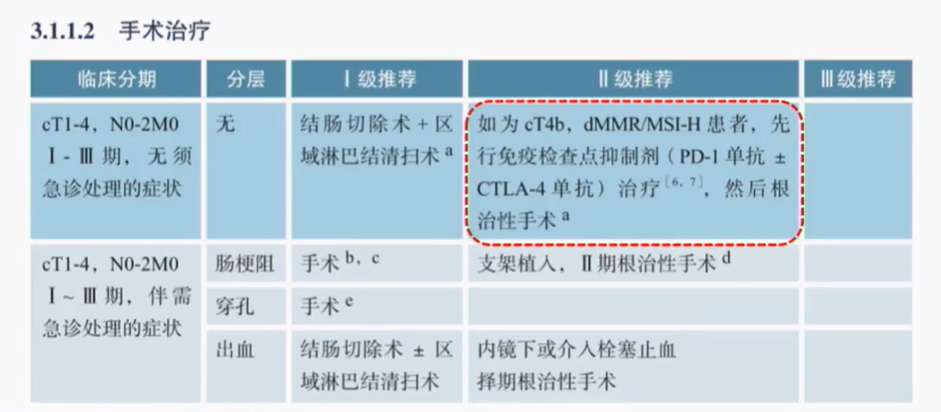
證據來源:
這一改動主要源於2022年多項免疫治療研究結果,其中最值得關注的研究成果是NICHE-2研究。NICHE-2研究是一項研究者發起的非隨機、多中心研究,旨在評估納武利尤單抗(nivolumab)聯合伊匹木單抗(ipilimuma)作為新輔助治療在局晚期結腸癌患者中的療效和安全性。在去年ESMO大會上,NICHE-2研究彙報了局部晚期dMMR結腸癌患者的新輔助免疫治療NICHE-2研究的安全性以及病理學緩解數據。
研究共入組120例患者,意向性分析(ITT)人群112例,符合方案(PP)人群107例。基線特征數據顯示,患者中位年齡為60歲,87%的患者確認為III期,其中74%的患者為高危III期。值得注意的是,放射學評估顯示,有63%的患者為T4a或T4b,48%的患者為高危(T4和N2)。
研究納入既往未經治療的非轉移性dMMR結腸腺癌患者,入組後的第1天接受1劑納武利尤單抗(3 mg/kg)+伊匹木單抗(1 mg/kg)治療,第15天接受1劑納武利尤單抗(3 mg/kg)治療,並在治療開始6周內接受手術。
研究有兩個主要終點,第一個是安全性和可行性,第二個是3年無病生存(DFS)率,次要終點包括:術後標本的主要病理緩解(MPR)率和pCR率等。其他探索性終點包括ctDNA動力學和轉化研究。
研究結果顯示,納武利尤單抗+伊匹木單抗新輔助治療dMMR結腸癌患者表現出優異的療效,MPR率為95%,pCR率為67%,且免疫治療耐受性良好,3-4級免疫相關不良事件發生率僅為4%。
陳功教授:
通過基因分型來對結直腸癌新輔助免疫治療提供指導,是今年CSCO結直腸癌診療指南更新中,對於臨床治療開展影響最大的部分之一。免疫治療在MSI-H/dMMR結直腸癌患者當中的療效得到驗證後,或將有效
改變結直腸癌診療的格局。目前,指南建議對於部分有術前新輔助治療計劃的患者,首先進行相關分子標誌物的檢測,以篩查選取符合條件的患者。對此類患者依照推薦方案進行管理,患者會獲得免於放化療等甚至手術治
療的可能。
其中,對於存在功能保留需求的患者,這一更新的價值尤為重要。以低位結直腸癌患者為例,既往外科治療中難以實現患者的肛門保留。即便采取放化療等手段實現肛門保留,也難免帶來生育功能、卵巢功能喪失的相關問。而當前指南更新所提及的,基於基因型的免疫治療策略在新輔助治療領域的應用,為避免上述情況提供了可能,患者有機會在免於功能喪失的前提下,實現腫瘤的治愈。這一變更目前已經取得了全球各地區頂尖指南的共識,也符合全球學界的觀點變化。
MSI-H 早期直腸癌 II 級推薦有保肛意願增加 IO 推薦的注釋:
對於 dMMR/MSI-H 的患者,可考慮根據 MSKCC 局部進展期直腸癌免疫治療臨床研究的結果外推,經 MDT 討論後可考慮先行免疫檢查點抑製劑治療,然後評估是否手術和手術方案。
進展期結直腸癌以 MMR/MS 狀態進行分層,增加注釋:
對於 dMMR 患者,可考慮新輔助免疫治療;對於 pMMR LARC 增加多個小樣本研究顯示聯合 IO 可提高 pCR 的注釋。
這一更新的主要依據,來源於2022年ASCO於NEJM聯合發布的一項PD-1抗體新輔助治療局部晚期、錯配修複基因缺失(dMMR)直腸癌II期臨床試驗結果。該研究是擬納入30例dMMR的II-Ⅲ期的直腸癌患者,計劃將PD-1抗體多塔利單抗(dostarlimab)單藥治療(每三周1次,持續6個月)用於dMMR II-III期直腸腺癌患者,然後接受標準的同步放化療和手術。完成dostarlimab治療後達到臨床完全緩解的患者不再接受化放療和手術。
主要終點:(1)完成dostarlimab免疫治療後12個月時持續臨床完全緩解率(cCR)或完成dostarlimab免疫治療(接受或不接受放化療)後病理學完全緩解率(pCR),(2)接受dostarlimab新輔助治療(接受或不接受化放療)後總體緩解(ORR)。
截至ASCO年會數據總共18例患者入組,其中前14例患者(包括NEJM投稿的12例)完成了6個月的全程dostarlimab免疫新輔助治療,中位隨訪12個月。這14位患者均接受了直腸指檢、直腸磁共振、PET-CT及腸鏡活檢評估,結果顯示所有患者全部獲得cCR。無患者接受放化療或手術治療,隨訪期間(6~25個月)無進展或複發病例報告。沒有3級或3級以上不良事件的報道。
另一項研究數據則是2023年3月1日,中山大學徐瑞華教授、王峰教授及陳功教授共同通訊在 Lancet 子刊
Gastroentrology & Hepatology
(IF=45)在線發表題為
Neoadjuvant PD-1 blockade with sintilimab in mismatch-repair deficient, locally advanced rectal cancer: an open-label, single-centre phase 2 study
的研究論文,該研究報道了信迪利單抗用於錯配修複缺陷的局部晚期直腸癌新輔助治療的Ⅱ期臨床研究。
該研究共有17例患者入選,並接受了至少1劑信迪利單抗。1例患者被排除在療效分析之外,因為他們在第一個信迪利單抗周期後失去了隨訪。其餘16例患者中,6例接受手術治療,其中3例病理完全緩解。另有9例患者臨床完全緩解,選擇觀察等待策略。1例患者出現嚴重不良事件並停止治療;該患者沒有完全的臨床反應,拒絕接受手術。12例患者完全緩解。3例接受手術但沒有病理完全緩解的患者中,有1例在最初4個周期的信迪利單抗治療後顯示腫瘤體積增加(此時他們接受了手術);該患者被認為對免疫檢查點抑製劑有原發性耐藥。中位隨訪17.2個月後,所有患者均存活,無患者複發。隻有1例(6%)患者出現3~4級不良事件,被認為是嚴重不良事件。
陳功教授:
當前早期直腸癌/結腸癌的新輔助治療策略應當進行較為重大的調整,新輔助治療應當基於MMR/MSI狀態開展。目前,NCCN指南也已經全麵基於MMR/MSI狀態進行相關的推薦治療。
切緣不保證、手術創傷大的局晚結腸癌(T4b)建議新輔助治療;
所有計劃做新輔助的結直腸癌患者均應治療前明確MMR/MSI狀態;
MSI-H LACRC,免疫治療提供了最佳療效及非手術治療策略。
微小殘留病灶/分子殘留病灶(MRD)的定義是:在沒有疾病影像學證據的情況下,在手術切除(或其他根治性治療)後腫瘤的存在證據。ctDNA檢測未來可能成為MRD是否能夠完全清零的新標準。
2022版CSCO指南首次提出可使用ctDNA檢測MRD:“近期有研究顯示,動態ctDNA監測有助於提前預警術後複發轉移,但其是否應該被常規用於術後隨訪並指導治療仍存在爭議。”
23版指南“病理診斷原則”部分,新指南則增加了注釋“s”,描述ctDNA檢測MRD的價值,重點介紹技術方法優缺點。
術後輔助化療則增加注釋“i”,指出術後輔助化療可能需要參考MRD結果製定方案。
上述更新的主要證據來源於2022 年 ASCO 上來自澳大利亞的 DYNAMIC 研究,這是首個基於 ctDNA(MRD)結果給予個性化治療方案的隨機對照研究,該研究是一項 2 期、多中心、隨機對照試驗。患者以 2∶1 的比例被隨機分組,一組患者根據 ctDNA 結果接受治療,即 ctDNA 指導管理組;另一組患者進行標準治療,即標準管理組。
首個基於 ctDNA(MRD)結果給予個性化治療方案的隨機對照研究,該研究是一項 2 期、多中心、隨機對照試驗。患者以 2∶1 的比例被隨機分組,一組患者根據 ctDNA 結果接受治療,即 ctDNA 指導管理組;另一組患者進行標準治療,即標準管理組。這提示,輔助化療可能在一個明確的Ⅱ期結腸癌患者亞組(即術後可檢測到 ctDNA 的患者)中有生存獲益。與標準治療相比,僅對 ctDNA 可檢測到的患者進行治療可降低接受輔助治療的患者的比例,且不影響無複發生存率。
陳功教授:
目前ctDNA檢測MRD技術在臨床進行大規模開展仍然受到部分條件的限製。但在可預見的未來必然是臨床診療的重要組成部分。既往的臨床診療過程中,一般認為結直腸癌在未發生遠處轉移的情況下,可以通過根治性手術將腫瘤完全清除。然而由於部分腫瘤邊界不明顯及早期的逃逸,根治性手術後仍可能存在影像學不可見的分子殘留病灶。而ctDNA檢測技術的目的即通過檢測ctDNA水平,以判斷患者腫瘤是否得到完全清除,進而評估患者複發風險。
MRD檢測的核心價值,是提供結直腸癌患者術後輔助治療的指導意見,幫助實現術後精準化診療。目前的應用場景包括但不限於幫助患者早期發現腫瘤複發風險及早介入,幫助化療耐受程度不佳的患者免於非必要化療,以及為相關術後輔助治療方案製定提供參考信息。事實上,MRD檢測技術的落地,對於患者術後輔助治療的管理以及我國醫療資源的節約都是有著重要價值的。隨著技術的逐步成熟,未來在各大實體瘤領域MRD檢測對術後治療的指導都將逐步落地。
然而,當前MRD也確實存在部分問題尚待解決。以技術檢測標準問題為例,目前MRD的檢測主要包括ctDNA甲基化檢測和ctDNA突變檢測兩種方向,而ctDNA突變檢測又分為Tumor-informed assays (WES+個性化panel)和Tumor agnostic assays (固定NGS Panel)。前者是指對腫瘤組織進行全外顯子(WES)測序以鑒定腫瘤患者的特異基因組變異圖譜,然後設計引物定製個性化Panel,對患者血漿進行超高深度ctDNA測序。無需原發腫瘤組織,通常以實體瘤驅動基因和靶向藥物基因為設計思路,製定與腫瘤類型相關的固定Panel,對患者血漿進行超高深度ctDNA動態監測。目前來看,Tumor-informed assays這一技術路線的敏感度相對較高,但仍然需要進一步的探索。我們也希望大家結合目前前沿的臨床研究,去自行判斷。
但MRD檢測技術的前景仍然是光明的,可以相信,未來隨著MRD檢測相關研究成果的不斷湧現,以及相應商業化產品價格的逐步降低,這一技術未來可能會成為腫瘤患者的一項重要檢查評估手段,甚至在一定範圍內取代ct等傳影像學手段,成為各實體瘤領域診斷評估的新選擇。

