眾所周知,軟組織肉瘤(STS)是起源於間質成分的高度異質性惡性腫瘤。由於其高死亡率和複發率,學者們傾向於評估內部微環境狀態與患者臨床結果之間的關係。腫瘤血管生成是軟組織肉瘤必不可少的生物學行為,為腫瘤細胞提供氧氣和營養,對腫瘤的增殖、轉移和預後起著重要作用。低氧狀態是血管生成的開關。在所有感知缺氧並作出反應的分子中,缺氧誘導因子-1α(HIF-1α)是調節氧平衡的最關鍵因素。
在缺氧條件下,HIF-1α的降解被抑製;隨後,HIF-1α與紅細胞生成素和血管內皮生長因子等靶基因啟動子區域的缺氧反應元件結合,促進腫瘤血管生成,誘發腫瘤進展。雖然HIF-1α還沒有被納入STS的治療策略,但一些研究已經報道了HIF-1α作為STS可能的預後標誌物的潛力。此外,有研究認為,HIF-1α狀態高可能導致STS的抗藥性水平更高。
目前,臨床上通常使用穿刺活檢來獲取術前腫瘤的組織病理學信息;然而,由於肉瘤成分的高度異質性,穿刺活檢可能會因為采樣誤差而低估組織內適當的組織學表達水平。磁共振成像(MRI)由於其高軟組織分辨率和多序列成像,已被廣泛應用於惡性腫瘤的影像學-病理控製研究。一些定量的功能MRI方法已被用於評估腫瘤氧合狀態,如基於血氧水平的功能MRI(BOLD-fMRI)、擴散加權成像(DWI)和動態對比增強MRI(DCE-MRI)方法。BOLD-fMRI可用於評估腫瘤的氧合水平。然而,BOLD-fMRI圖像采集時需要吸氧,十分麻煩,因此不適合常規臨床應用。DWI可以通過缺氧狀態下的細胞水平間接反映腫瘤的氧合狀態,其衍生參數表觀擴散係數(ADC)值與HIF-1α明顯相關。此外,一些研究者已經證明,用DCE-MRI進行藥代動力學建模產生的定量參數可以通過腫瘤供血水平預測HIF-1α的表達。然而,定量參數對HIF-1α表達水平的反映在不同組織學類型的腫瘤中似乎存在爭議。在宮頸癌和卵巢癌中,HIF-1α與DCE-MRI灌注參數之間似乎是正相關的,而其他研究報告的結論則相反,對於ADC值預測HIF-1α表達的能力也存在分歧。因此,任何單一的成像方法都不夠敏感,無法反映腫瘤的氧合狀態。相反,多參數成像的綜合應用有望在評估腫瘤缺氧方麵發揮更關鍵的作用。此外,以往的研究大多通過測量感興趣區域(ROI)來反映STS的組織微觀結構。然而,STS內的組織成分是高度異質性的,腫瘤的小ROI測量不能完全反映癌症的異質性。相反,全腫瘤直方圖分析是一種能提供更客觀、更準確的組織特征和異質性的定量信息的方法,而且讀取者之間的差異最小。
近日,發表在EuropeanRadiology雜誌的一項研究利用全腫瘤直方圖分析法將DWI和DCE-MRI的定量參數與STS的HIF-1α進行了相關性分析,並確定了可用於預測HIF-1α表達的獨立因素。
本項研究招募了71名接受3.0T MRI檢查的STS患者,包括常規MRI、DWI和DCE-MRI序列。使用常規MRI圖像確定了腫瘤的位置、最大直徑、包膜、T2加權的腫瘤異質性、瘤周水腫、瘤周增強、壞死、尾狀形態、骨質侵襲、血管/神經侵襲和/或包裹。整個腫瘤的直方圖指標是根據表觀擴散係數(ADC)、Ktrans、Kep和Ve圖計算的。獨立樣本t檢驗和單因素方差分析用於檢驗正常分布的分類數據與HIF-1α表達之間的差異。進行Pearson和Spearman相關分析和多元線性回歸分析以確定直方圖指標與HIF-1alpha表達之間的相關性,並使用Kaplan-Meier方法繪製了生存曲線。
關於傳統的MRI特征,隻有T2加權圖像上的高度異質性(55.6 ± 19.9% vs. 45.4 ± 20.5%,p = 0.041)和超過50%的壞死麵積(57.3 ± 20.4% vs. 43.9 ± 19.7%,p = 0.002)容易表明HIF-1α表達較高的STS。從ADC(平均值、中位數、第10和25個百分點的數值)、Ktrans(平均值、中位數、第75和90個百分點的數值)和Kep(第90個百分點的數值)得到的直方圖指標與HIF-1α表達明顯相關。多重線性回歸分析表明,50%以上的壞死、ADC偏斜度、Ktrans90th和III級與HIF-1α表達獨立相關。
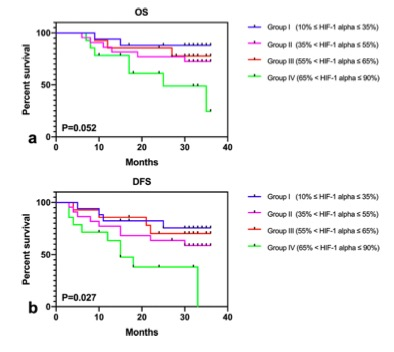
圖圖為根據不同的HIF-1α組別和中位數劃分的OS(a)和DFS(b)的Kaplan-Meier生存曲線圖,根據不同的HIF-1α組別,按四分位數和中位數進行分類
本項研究表明,DWI和DCE-MRI直方圖參數與STS的HIF-1α表達明顯相關,這為臨床進行早期的風險分層評估提供了技術支持。
原文出處:
Xiangwen Li,Yiwen Hu,Yuxue Xie,et al.Whole-tumor histogram analysis of diffusion-weighted imaging and dynamic contrast-enhanced MRI for soft tissue sarcoma: correlation with HIF-1alpha expression.DOI:10.1007/s00330-022-09296-z