前列腺癌(PCA)作為全球男性中最常見的癌症之一,其終生患病風險約為13%,死亡率為20%。放射性療法(RT)是局部性前列腺癌患者的主要治療治療;然而,5.3-12.6%以及50%的高危PCA患者在初次放療和挽救性放療後出現了疾病的複發。
既往研究顯示,電離輻射(IR)能夠以兩種不同的機製誘導癌細胞的死亡,包括DNA損傷的直接作用,以及活性氧(ROS)產生相關的間接抗腫瘤作用。輻射誘導的ROS會破壞癌細胞的完整性並伴隨著DNA損傷的發生。
既往研究發現,幾種RT增敏劑可通過增強線粒體內的ROS水平能夠克服缺氧誘導的RT 抵抗。天然存在的化合物5-氨基酮戊酸(5-ALA)是血紅素生物合成的前體,外源施用的5-ALA可通過血紅素生物合成途徑在線粒體中酶促轉化為原卟啉IX(PpIX)。當累積的PpIX被波長為625–635 nm的光激發時,會產生ROS。
5-ALA目前已被用作光動力療法(ALA-PDT)中的光敏劑。在該研究中,研究人員旨在探究5-ALA是否可通過其代謝物PpIX產生ROS來提高前列腺癌細胞對放射性療法的敏感性。
研究人員檢測5-ALA對電離輻射處理的PC-3和DU-145 PCA細胞係的影響,並通過克隆形成測定、線粒體功能和常氧或缺氧條件下ROS的產生評估上述的影響。

5-ALA對PCA細胞放療敏感性的影響
結果顯示,使用5-ALA處理細胞,在暴露於IR後能夠迅速增強線粒體中ROS的產生,並通過上調細胞內PpIX的水平降低線粒體膜電位。IR聯合5-ALA可誘導線粒體功能障礙的發生並增加ATP的產生,將能量代謝轉換為靜止狀態。進一步的研究顯示,在缺氧條件下,IR聯合5-ALA可誘導ROS的劇烈增加及線粒體功能障礙的發生,從而降低癌細胞的幹細胞特性和放療抗性。
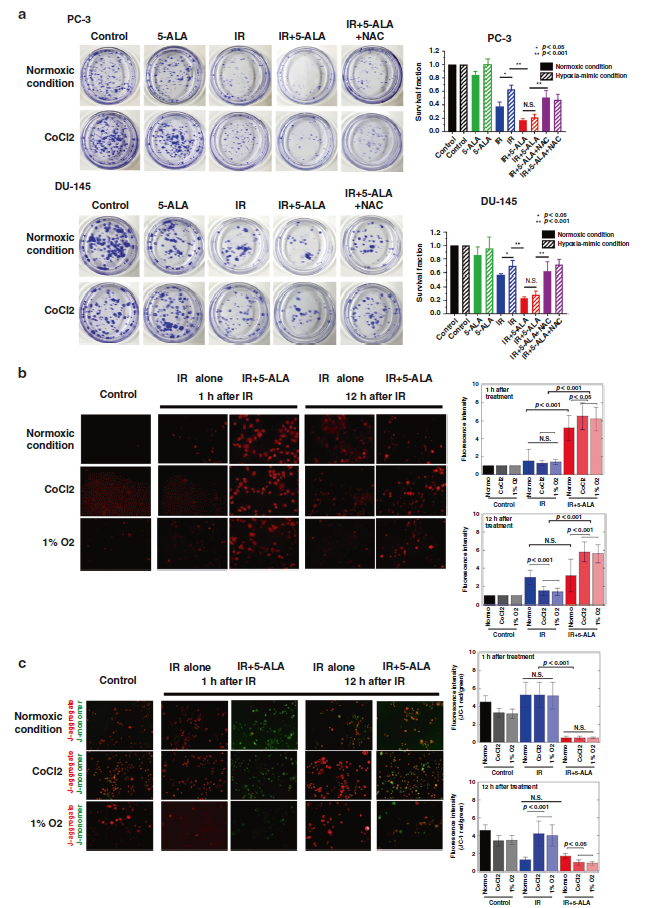
在缺氧條件下5-ALA可作為放療增敏劑
總而言之,該研究結果表明,5-ALA聯合放射性療法的治療策略能夠提高放療對前列腺癌的治療效果。
原始出處:
Owari, T., Tanaka, N., Nakai, Y. et al. 5-Aminolevulinic acid overcomes hypoxia-induced radiation resistance by enhancing mitochondrial reactive oxygen species production in prostate cancer cells. Br J Cancer (01 April 2022). https://doi.org/10.1038/s41416-022-01789-4.